研究背景:产新德里金属β-内酰胺酶(NDM)的肺炎克雷伯菌能够水解氨曲南以外的所有β-内酰胺类抗生素,给感染该菌的患者的治疗带来挑战。blaNDM-5基因首次发现于大肠杆菌菌株EC045中[1],随后该基因在肺炎克雷伯菌中被检测到,并在全球范围内引起散在爆发[2]。目前已在多种ST型的肺炎克雷伯菌中发现该基因,但是同时合并高毒表型的菌株鲜有报道。对于耐碳青霉烯-高毒力肺炎克雷伯菌引起的感染,治疗方案十分有限[3]。在此,我们报道了一例由产NDM-5的ST65型高毒力肺炎克雷伯菌引起的肺移植患者的严重感染,应当引起我们的关注。
病例回顾:2019年,一名肺移植患者经历了严重的术后感染。在术后第2、5、6和7天,将多个标本进行病原学检测,在结果返回前根据患者的症状进行经验性抗菌治疗 (图1A)。收到药敏结果后立即服用氨曲南等抗菌药物,患者体温和循环逐渐改善。然而,患者在术后第10天出现了肺气肿,支气管镜检查显示大量脓苔,患者的病情急剧恶化并最终死于脓毒性休克。
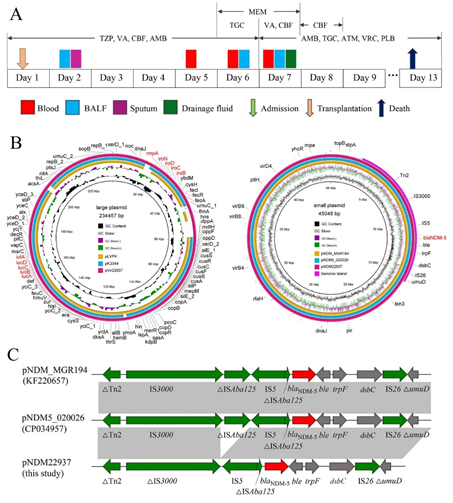
实验结果:从患者的不同标本中分离到8株肺炎克雷伯菌,这些菌株对多种抗菌药物,包括碳青霉烯类、头孢菌素类和β-内酰胺/β-内酰胺酶抑制剂高度耐药,但对氨曲南、替加环素和粘菌素敏感,酶抑制剂增强实验证明这些菌株能够产生金属β-内酰胺酶。我们把从四种不同类型标本里分离的第一株菌进行二代基因组测序,同时对分离自血液的菌株KP22937进行三代测序,获得了完整的染色体和质粒序列。
分析表明,菌株KP22937属于ST65和荚膜血清型K2,携带iucABCDiutA和iroBCDN等高毒基因簇,以及一个高粘表型调节基因rmpA。小鼠致死试验表明,注射了KP22937菌悬液(浓度为105 CFU/ml)的所有8只小鼠均在12小时内死亡,而注射低毒力肺炎克雷伯菌和PBS的小鼠均存活了一周以上。上述结果表明,引起移植患者严重感染的ST65型肺炎克雷伯菌属于高毒力肺炎克雷伯菌。
菌株KP22937中共鉴定出两个质粒。质粒pNDM22937,大小为45048 bp,属于IncX3。除blaNDM-5外,该质粒不含其它耐药基因。利用BLASTN对GenBank进行搜索,结果表明pNDM22937与不同ST型的肺炎克雷伯菌以及其它肠杆菌科细菌中携带blaNDM-5的质粒几乎相同。具体而言,pNDM22937与来自大肠杆菌的质粒pNDM5_020026 (CP034957)显示100%的一致性和覆盖率。与质粒pNDM_MGR194 (KF220657)具有100%一致性和97%覆盖率,该质粒是从肺炎克雷伯菌中发现的典型的携带blaNDM-5的质粒(图1B)。菌株KP22937中blaNDM-5基因的遗传环境(DTn2-DIS3000-IS5-DISAba125-blaNDM-5-ble-trpF-dsbC-IS26-DumuD)与pNDM_MGR194和pNDM5_020026十分相似,只是在pKP22937中删除了部分IS3000的下游区域和ISaba125的上游区域(图1C)。此外,我们在质粒pNDM22937中发现了一个带有15个开放阅读框的基因组岛区(图1B),基因blaNDM-5及其侧翼内容也存在于该区域。
在pNDM22937中也鉴定了几个接合转移基因(图1B)。接合实验表明,菌株KP22937能将携带blaNDM-5的质粒转移到受体大肠杆菌EC600中,接合频率为10-5(转移接合子/受体)。通过PCR扩增测序以及S1-PFGE实验证实了接合成功,表明blaNDM-5位于一个自主转移质粒上,可介导耐药性的传播。大肠杆菌受体菌EC600对所有常用抗菌药物都敏感,而在获得含有基因blaNDM-5的质粒后,显示出与菌株KP22937相似的抗性表型,并且生长情况与原始受体菌EC600生长几乎没有区别,揭示了获得IncX3质粒不会给宿主带来适应成本。因此,我们推测本研究中导致肺移植患者术后感染的高毒力高耐药菌株是由高毒力肺炎克雷伯菌获得携带blaNDM-5基因的IncX3质粒而产生的。
在没有抗生素压力的情况下,质粒中存在的耐药基因会增加宿主的适应成本[4]。然而,最近的一项体外研究表明,高达75.9%(22/29)的肠杆菌科菌株通过接合试验获得IncX3质粒后不产生适应成本[5],这可能有助于质粒的传播。基因组岛是细菌和古菌中通过水平基因转移获得的基因簇。此前的一项研究表明,基因组岛是基因组进化的主要驱动因素,它们可以增强细菌在生态位内的适应性[6]。在本研究中,blaNDM-5基因及其侧翼内容位于质粒pNDM22937的基因组岛区,这可能有助于降低肺炎克雷伯菌KP22937的适应性成本。总之,较低的适应成本可以部分解释blaNDM-5在肠杆菌科菌株中的快速传播。
研究结论:这项研究报告了一例移植后患者的致命感染,该感染由产NDM-5的ST65型高毒力肺炎克雷伯菌引起。blaNDM-5基因位于一个可自主转移的IncX3质粒上,该质粒可转移到大肠杆菌中,并且没有显著的适应性成本。目前的发现引起了对IncX3质粒介导的blaNDM-5基因水平传播的关注,而高毒力肺炎克雷伯菌株也参与其中。
该论文于 2021 年 3月5日发表于Emerging Microbes & Infections, 10:1, 396-399.
1.Hornsey M, Phee L, Wareham DW. A novel variant, NDM-5, of the New Delhi metallo-beta-lactamase in a multidrug-resistant Escherichia coli ST648 isolate recovered from a patient in the United Kingdom. Antimicrob Agents Chemother. 2011 Dec;55(12):5952-4. doi: 10.1128/AAC.05108-11. PubMed PMID: 21930874; PubMed Central PMCID: PMCPMC3232805.
2.Rojas LJ, Hujer AM, Rudin SD, et al. NDM-5 and OXA-181 Beta-Lactamases, a Significant Threat Continues To Spread in the Americas. Antimicrob Agents Chemother. 2017 Jul;61(7):e00454-17. doi: 10.1128/AAC.00454-17. PubMed PMID: 28461314; PubMed Central PMCID: PMCPMC5487671.
3.Shen Z, Gao Q, Qin J, et al. Emergence of an NDM-5-Producing Hypervirulent Klebsiella pneumoniae Sequence Type 35 Strain with Chromosomal Integration of an Integrative and Conjugative Element, ICEKp1. Antimicrob Agents Chemother. 2020;64(1):e01675-19. doi: 10.1128/AAC.01675-19. PubMed PMID: 31611359.
4.Andersson DI, Hughes D. Antibiotic resistance and its cost: is it possible to reverse resistance? Nature reviews Microbiology. 2010 Apr;8(4):260-71. doi: 10.1038/nrmicro2319. PubMed PMID: 20208551.
5.Ma T, Fu J, Xie N, et al. Fitness Cost of blaNDM-5-Carrying p3R-IncX3 Plasmids in Wild-Type NDM-Free Enterobacteriaceae. Microorganisms. 2020 Mar 7;8(3):377. doi: 10.3390/microorganisms8030377. PubMed PMID: 32156014.
6.Dobrindt U, Hochhut B, Hentschel U, et al. Genomic islands in pathogenic and environmental microorganisms. Nature reviews Microbiology. 2004 May;2(5):414-24. doi: 10.1038/nrmicro884. PubMed PMID: 15100694.
更多内容,请点击查看原文
本网站内容转载须联系版权方授权



